Kestabilan Unsur
Gas Mulia
Susunan elektron stabil mengikuti kaidah oktet dan duplet
- kaidah oktet menyatakan bahwa atom- atom cenderung memiliki 8 elektron pada kulit terluar seperti konfigurasi elektron gas mulia
- Kaidah duplet menyatakan atom-atom dengan nomor atom kecil cenderung memiliki 2 elektron pada kulit terluarnya seperti konfigurasi elektron gas mulia He

Untuk memenuhi kaidah tersebut maka akan tejadi pelepasan elektron dan penarikan elektron.
Kestabilan Unsur
Pada umumnya atom tidak berada dalam keadaan bebas, tetapi bergabung dengan atom lain membentuk senyawa. Atom-atom bergabung menjadi senyawa yang lebih stabil dengan mengeluarkan energi. Atom-atom bergabung karena adanya gaya tarik-menarik antara dua atom. Gaya tarik-menarik antar atom inilah yang disebut ikatan kimia.Konsep ikatan kimia pertama kali dikemukakan oleh Gilbert Newton Lewis dan Langmuir dari Amerika Serikat, serta Albrecht Kossel dari Jerman pada tahun 1916. Adapun konsep tersebut sebagai berikut:
Lewis

•Kenyataan bahwa gas mulia (He, Ne, Ar, Kr, Xe, dan Rn) sukar membentuk senyawa (sekarang telah dapat dibuat senyawa dari gas mulia Kr, Xe, dan Rn), merupakan bukti bahwa gas-gas mulia memilki susunan elektron yang stabil.
•Setiap atom memiliki kecenderungan untuk mempunyai susunan elektron yang stabil seperti gas mulia, dengan cara melepaskan elektron, menerima elektron, atau menggunakan pasangan elektron secara bersama-sama.
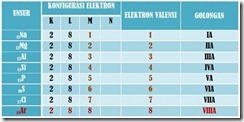
Gas mulia adalah unsur-unsur golongan VIIIA (18) dalam tabel periodik. Disebut mulia karena unsur-unsur ini sangat stabil (sangat sukar bereaksi). Tidak ditemukan satupun senyawa alami dari gas mulia. Menurut Lewis, kestabilan gas mulia tersebut disebabkan konfigurasi elektronnya yang terisi penuh, yaitu konfigurasi oktet (duplet untuk Helium). Kestabilan gas mulia dicerminkan oleh energi ionisasinya yang sangat besar, dan afinitas elektronnya yang sangat rendah (bertanda positif). Para ahli zaman dahulu yakin bahwa unsur-unsur gas mulia benar-benar inert. Pendapat ini dipatahkan, setelah pada tahun 1962, Neil Bartlett, seorang ahli kimia dari Kanada berhasil membuat senyawa xenon, yaitu XePtF6. Sejak itu, berbagai senyawa gas mulia berhasil dibuat.
Gas mulia adalah gas yang mempunyai sifat lengai, tidak reaktif, dan susah bereaksi dengan bahan kimia lain. Gas mulia banyak digunakan dalam sektor perindustrian. Berikut adalah gas-gas mulia:
Ikatan kimia adalah sebuah proses fisika yang bertanggung jawab dalam interaksi gaya tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil. Penjelasan mengenai gaya tarik menarik ini sangatlah rumit dan dijelaskan oleh elektrodinamika kuantum. Dalam prakteknya, para kimiawan biasanya bergantung pada teori kuantum atau penjelasan kualitatif yang kurang kaku (namun lebih mudah untuk dijelaskan) dalam menjelaskan ikatan kimia. Secara umum, ikatan kimia yang kuat diasosiasikan dengan transfer elektron antara dua atom yang berpartisipasi. Ikatan kimia menjaga molekul-molekul, kristal, dan gas-gas diatomik untuk tetap bersama. Selain itu ikatan kimia juga menentukan struktur suatu zat.
STRUKTUR LEWIS
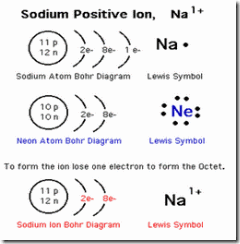
Perhatikan diagram Niels Bohr (struktur atom) natrium. Protonnya 11, netron = 12, berarti elektronnya 11.
Konfigurasi elektron Na(2,8,1).
Struktur Lewis menggambarkan elektron valensi. Karena elektron valensi Na = 1, maka struktur Lewis Na seperti terlihat pada gambar.
Lihat neon, konfigurasi elektronnya Ne(2,8)
maka pada struktur Lewis Ne tertulis 8 elektron (4 pasang elektron).
Nah, ketika atom Na bereaksi, melepaskan 1 elektron valensinya, menjadi ion Na+. Karena elektron valensi Na telah lepas, maka struktur Lewisnya tanpa elektron lagi.
Pengembangan Konsep: Mengapa setelah bereaksi, Na menjadi ion Na+? Lihat elektron valensinya. Ion natrium bermuatan +1 karena elektron valensinya 1. Setelah menjadi ion Na+, elektronnya tinggal 10, seperti neon, Ne(2,8). Berarti Ne dan Na+ isoelektronik, yaitu memiliki jumlah elektron yang sama.
Dapatkah Na+(2,8) melepaskan lagi elektron? Sangat sulit, karena elektronnya sudah stabil seperti neon dan sudah bermuatan +1, sehingga energi ionisasi, yaitu energi yang diperlukan untuk melepas elektron kedua sangat besar. Oleh karena itu, dalam reaksi Na hanya melepas 1 elektron dengan energi ionisasi yang relatif kecil.



0 komentar:
Posting Komentar